Seit der 80er Jahren ist bekannt, dass sich die DNS Methylierung in Tumorzellen sich grundlegend von derjenigen in gesunden Zellen unterscheidet. Während die globale DNS Methylierung in Krebszellen meist geringer ist als in normalen Zellen (Hypomethylierung), sind in vielen Krebszellen die Genpromotoren übermässig methyliert (Hypermethylierung). Auch in Darmkrebs sind zahlreiche schützende Gene (Tumor Suppressoren) infolge Promoter Hypermethylierung inaktiviert. In den 90er Jahren wurde erkannt, dass in gesunden Zellen der normalen Darmschleimhaut von Patienten mit Darmkrebs die Methylierung in einigen Genpomotoren mit ansteigendem Alter zunimmt. Wichtige Fragen blieben aber unbeantwortet: (i) Ist die durch Hypermethylierung bedingte Inaktivierung von Tumor Suppressoren in Darmkrebszellen auch die Ursache der Entstehung von Polypen und Darmkrebs? (ii) Besteht ein kausaler Zusammenhang zwischen der altersabhängigen Zunahme der Promoter Methylierung in gesunden Zellen der normalen Darmschleimhaut und dem erhöhten Darmkrebs Risiko im Alter? (iii) Was sind die Ursachen der Instabilitäten der Promoter Methylierung mit zunehmendem Alter?
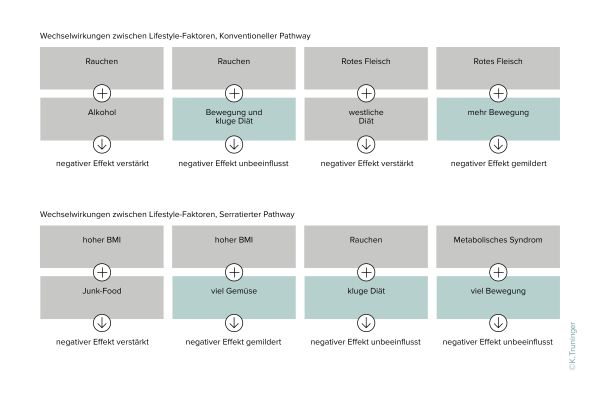
Im Gegensatz zu den relativ statischen Genen können äussere Einflüsse auf epigenetische Muster einwirken, d.h. Umweltfaktoren können Methylierungsmuster von Genen beeinflussen und dadurch Einfluss auf deren Funktion nehmen. Somit können Umweltfaktoren auf die Funktion der DNS einwirken, ohne dass dabei deren Struktur verändert wird, und dabei die Entstehung von Krebs begünstigen. Die Epigenetik stellt demnach ein variables Scharnier zwischen der Umwelt und der Funktion des Erbgutes dar.
In den vergangenen 10 Jahren ist unser Team den genannten Fragen und dem Einfluss von Lifestyle Faktoren auf die molekularen Veränderungen bei der Entstehung von Darmkrebs im Rahmen einer klinisch-biologischen Zusammenarbeit mit systematischen Analysen nachgegangen.
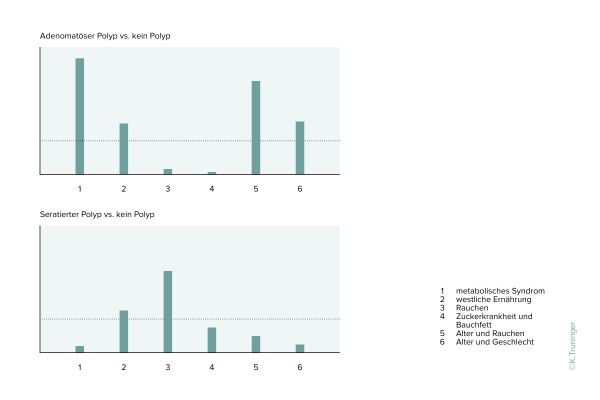
Die Resultate unserer bisherigen Projekte zeigen, dass Darmkrebs relevante Methylierungsmuster durch Lifestyle Faktoren beeinflusst werden und bereits in normaler Schleimhaut nachweisbar sind. Die Analyse dieser Veränderungen hat demnach das Potential, Personen mit erhöhtem Darmkrebsrisiko zu identifizieren. In der SWEPIC Studie wird das Potential von Analysen der Methylierung für die Früherkennung und Prävention von Darmkrebs untersucht.